2023年1月23日,清华大学免疫学研究所董晨院士团队在《Journal of Experimental Medicine》杂志在线发表了题为“STAT3 regulates CD8+ T cell differentiation and functions in cancer and acute infection”的研究论文。该研究详细阐述了在肿瘤模型中STAT3信号通路调控CD8+ T细胞分化的功能及其分子机制。
STAT3(Signal transducer and activator of transcription 3)是STAT转录因子家族中的一员。在CD4+ T细胞的分化过程中,STAT3通过响应不同白细胞介素(Interleukin)分子的刺激来调控不同T细胞谱系的分化。过去的研究中,董晨团队首先报道了IL-6/23-STAT3调控Th17细胞的分化和IL-6/21-STAT3调控Tfh细胞的分化等。在肿瘤和慢性感染中,干细胞样耗竭型T细胞(Stem-like/Progenitor exhausted T cells, Texprog cells)会在肿瘤微环境中分化为终末耗竭型T细胞(Terminally differentiated Tex cells, Texterm cells)。然而, 这一个过程中的胞外信号和胞内转录调控机制还缺乏研究。
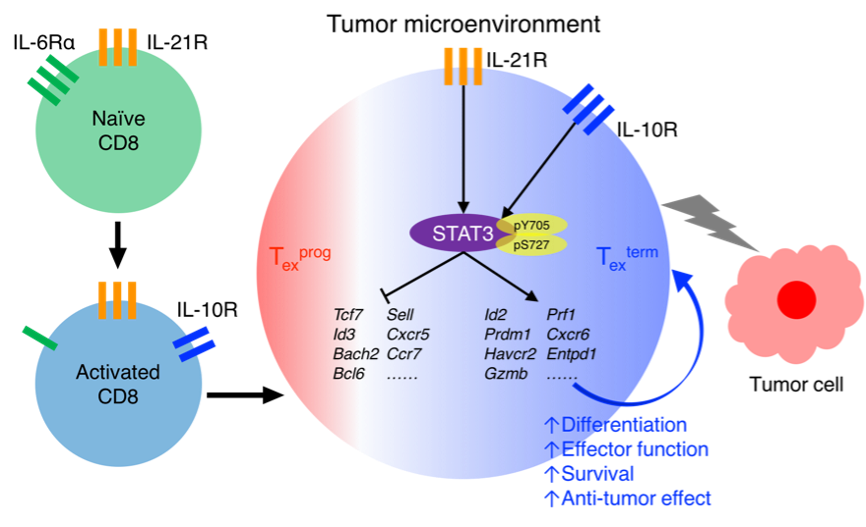
在本研究中,研究人员利用B16-OVA和E.G7小鼠肿瘤模型发现,Stat3在CD8+ T细胞中的特异性缺失导致其细胞毒性功能的受损以及T细胞数量的减少,进而导致肿瘤的生长速度显著加快。接下来,研究人员通过将肿瘤特异性CD8+ T细胞过继输送到相应的荷瘤小鼠中发现,Stat3的缺失导致肿瘤特异性的Texterm细胞的比例和数量显著减少、以及颗粒酶B的产生能力显著受损。这说明STAT3对于肿瘤特异性的Texterm细胞的分化和杀伤功能具有重要的调控作用。
接下来,研究人员通过分析STAT3上游白细胞介素受体的表达水平以及STAT3的磷酸化染色实验发现,IL-10和IL-21能够显著诱导肿瘤浸润CD8+ T细胞中STAT3在Tyr705和Ser727位点的磷酸化,而IL-6则不能。利用IL-6/10/21体外刺激CD8+ T细胞发现,IL-10/21通过完全或者部分依赖STAT3的方式显著诱导TIM-3+ Texterm细胞亚群的产生,以及抑制Texprog关键转录因子TCF1的表达。此外,体外实验结果显示,STAT3信号的激活能够显著提高CD8+ T细胞的抗凋亡和杀伤肿瘤的能力,但对其增殖能力没有显著影响。结合之前关于IL-10和IL-21在肿瘤浸润的CD8+ T细胞中的研究,该研究进一步阐明了IL-10/21-STAT3信号通路在体内外促进Texterm细胞分化的重要功能。
此外,研究人员通过整合分析CD8+ T细胞的pSTAT3(Tyr705) ChIP-seq和比较肿瘤浸润的WT和 Stat3-/- CD8+ T细胞RNA-seq数据发现,STAT3直接结合并促进表达的基因显著富集为Texterm细胞的特征基因,包括Prdm1, Tbx21,Havcr2和Gzmb等;而STAT3直接结合并抑制表达的基因则显著富集为Texprog的特征基因,包括Tcf7, Id3和Cxcr5等。这说明STAT3通过DNA结合的方式转录调控Texterm vs. Texprog细胞命运相关基因的表达,从而进一步调控二者的分化。
此外,研究人员通过分析肿瘤浸润的WT vs. Stat3-/- CD8+ T细胞的ATAC-seq数据发现,Stat3的缺失导致肿瘤特异性的CD8+ T细胞的染色质开放性的显著降低,包括在Texterm和Texprog细胞特异性的染色质开放性位点均有显著降低。此外,Stat3的缺失也导致CD8+ T细胞基因组的H3k27ac修饰水平的显著下降。这说明STAT3对于维持肿瘤浸润的CD8+ T细胞的染色质开放性和表观遗传性状发挥着重要的作用。通过对Stat3-/-细胞中显著下调的ATAC-seq区域进行转录因子结合Motif富集分析发现,AP-1家族的转录因子,尤其是BATF和IRF4被显著富集出来。同时,ChIP-qPCR的结果表明,Stat3的缺失导致BATF/IRF4在多个Texterm细胞特征基因位点的结合减弱。这说明STAT3可能和BATF/IRF4协同调控Texterm细胞的分化。
因此,本研究发现IL-10/21-STAT3信号通路在肿瘤特异性的Texterm细胞的分化、生存和杀伤功能中发挥着重要的作用。此外,研究人员发现,在李斯特菌急性感染模型中,STAT3在终末分化的效应型CD8+ T细胞的发育过程中同样发挥着类似的作用。因此,本研究为临床上利用STAT3信号通路及其上游白细胞介素分子来开发更加有效的抗肿瘤和抗感染免疫疗法提供了重要的理论基础。
清华大学医学院基础医学系直博生孙勤利为该论文的第一作者,清华大学免疫所PI、上海免疫治疗创新研究院院长、上海交通大学教授董晨院士为本文的通讯作者,其他参与人员包括清华大学免疫研究所和上海市免疫治疗创新研究院的实验室成员。本研究得到了来自国家自然科学基金委员会、国家重点研发项目、清华大学“春风基金”、上海本土高水平大学创新研究团队、清华大学-厦门长庚医院过敏性疾病联合研究中心和上海交通大学-毕诺济公司细胞疗法联合实验室等多个项目的支持。
原文链接:
https://doi.org/10.1084/jem.20220686

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
