
自身免疫性疾病是指一系列广泛的临床病症集合,由于自我免疫耐受的破坏而导致针对自身目标的免疫反应,进而形成组织病变和临床症状。尽管目前在针对相关炎症和组织病变过程中的细胞及分子机制方面取得了进展,但自身免疫性疾病的发病机制依然有待详尽研究。目前研究表明,除极少数由单基因突变引起的病例外,大多数自身免疫性疾病都存在复杂的遗传背景并进而导致疾病易感性。近年来,群体遗传学方法极大地丰富了我们对自身免疫疾病遗传易感性的认识,为我们提供了一个全面重新审视自身免疫相关基因和可能致病途径的机会之窗。在这篇综述中,作者旨在从人类遗传学的角度讨论常见自身免疫性疾病的发病机制。文本从总结自身免疫疾病的遗传学研究现状出发,接着分别探讨了自身免疫反应中由免疫学背景决定的异常先天性和适应性免疫反应以及炎症性细胞死亡。作者通过多角度总结讨论,开扩了人们对于自身免疫性疾病的遗传背景的认识,同时也强调了从多元角度分析不同分子和信号通路对于疾病发生发展的贡献。这些与遗传背景紧密相关的分子和信号通路为自身免疫性疾病提供了潜在的治疗靶点,因此是我们进一步研究认识自身免疫反应的重要切入点。
近日,SCIENCE CHINA Life Sciences(《中国科学:生命科学》英文版)在线出版了题为“Innate and adaptive immune abnormalities underlying autoimmune diseases: the genetic connections”的综述文章。该文由清华大学免疫学研究所胡小玉教授团队,清华大学免疫学研究所PI、上海免疫治疗创新研究院院长董晨院士团队,清华大学医学院、上海长征医院徐沪济教授团队,清华大学免疫学研究所林欣教授团队联合撰写。该综述从自身免疫病的易感性遗传背景分析、遗传因素相关的天然免疫异常、异常激活的自体适应性免疫、TNF诱导细胞坏死性凋亡相关的易感遗传背景四个方面论述了自身免疫性疾病最新研究进展,并对该领域的发展趋势进行了展望。
第一章“The genetic basis of autoimmune diseases”。尽管不同的自身免疫性疾病表现出截然不同的症状,但某些常见的遗传风险因素广泛地构成了自身免疫相关免疫异常的基础。本章基于全基因组关联分析(Genome-wide association study,GWAS),从流行病学角度分析了自身免疫性疾病的易感基因,并对不同自身免疫性疾病中共有的易感基因进行横向比较。本章进一步对自身免疫反应中的基因-环境互作,以及后GWAS时代的基因组学的功能分析等进行了讨论和展望。

第二章” Genetic components underlying innate immune abnormalities in autoimmune diseases”。本章中,作者根据人类遗传学研究获得的知识,讨论了遗传背景与免疫系统异常激活相关的因果联系,简要总结了与先天免疫功能,如树突状细胞、巨噬细胞和单核细胞等,有明显联系的风险基因。同时也通过对于分析讨论NOTCH信号通路和代谢相关通路相关的自身免疫性疾病易感遗传背景,强调了如何通过多角度研究解析疾病发生发展中的自身免疫反应,特别是一些与免疫调控非直接联系的风险基因与自身免疫的因果相关性,由此开发相应的潜在治疗靶点。

第三章“T cell and autoimmune diseases“。自身反应性 T 细胞的扩增是许多自身免疫性疾病的生物标志物,这对于协调先天性和适应性免疫反应以及诱导组织损伤至关重要。其中,CD4+ T细胞是主要贡献者。本章重点介绍了自身免疫性疾病相关的主要CD4+ T细胞亚群,包括辅助性T细胞17(Th17)、滤泡辅助性T细胞(Tfh)和调节性T细胞(Treg)的主要特征和效应性分子,及其在各类自身免疫性疾病中的功能。同时总结了近年来发现的自身免疫反应相关T细胞新亚群或新功能,包括分泌GM-CSF的CD4+ T细胞、调节性CD8+ T细胞、CD4和CD8双阴性T细胞以及组织驻留记忆性T细胞。T细胞,特别是Th17细胞,在促进自身免疫的发生发展中发挥重要功能,靶向T细胞及其效应分子在临床中已经取得了显著疗效。本章进一步对靶向Th17细胞、T细胞迁移及细胞疗法相关临床实验进行汇总和展望。
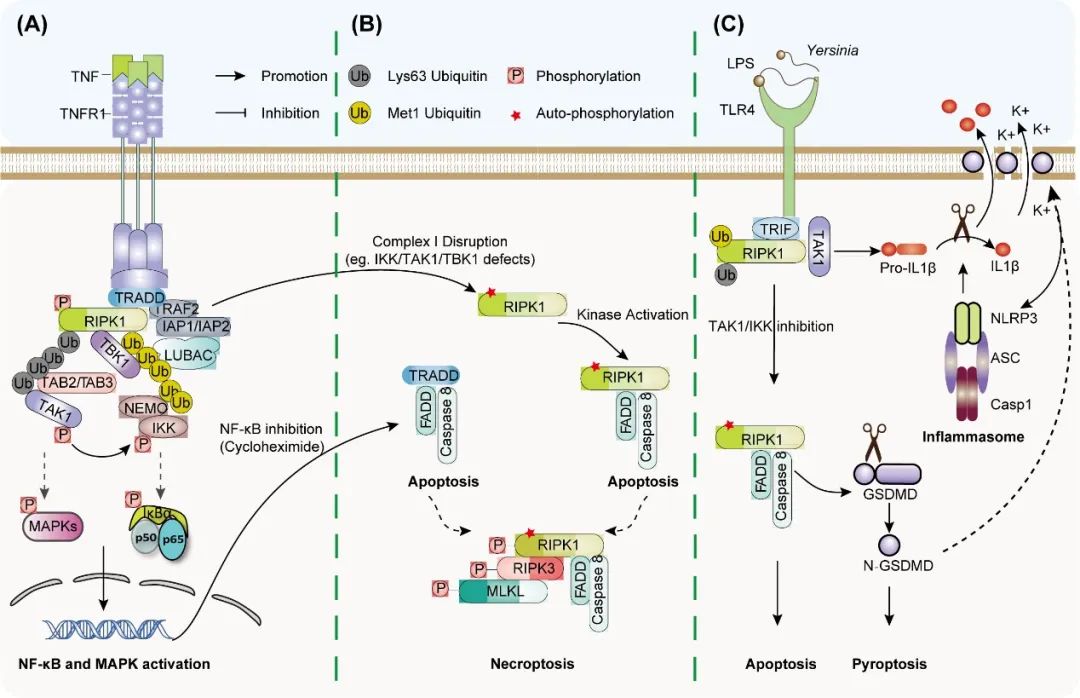
第四章“TNF receptor signaling and auto-inflammatory diseases: NF-κB and Necroptosis“。肿瘤坏死因子相关信号通路在细胞存活、扩增、死亡已经炎症反应中均发挥重要功能。本章中,作者重点讨论坏死性凋亡在由 NF-κB 通路相关基因(包括 NEMO、LUBAC、OTULIN 和 A20)突变引起的自身免疫性疾病发病机制中的重要作用。此外,总结了自身炎症性疾病中坏死性凋亡信号相关基因突变的最新进展,包括 RIPK1 相关自身炎症和其他坏死性凋亡介导的炎症性疾病。该章综述扩展了对自身免疫性疾病中 NF-κB 和 TNF 受体信号下游坏死性凋亡之间复杂相互作用的见解,并提供了靶向坏死性凋亡治疗相关人类疾病的未来方向。
治疗自身免疫性疾病的主要挑战是如何逆转异常的免疫反应。在本篇综述中,不仅针对最近的自身免疫疾病研究进行了总结,强调了分析自身免疫疾病相关的遗传因素,以及如何通过遗传背景研究更好地进行相关免疫调控功能探索,进而深入理解与自身免疫相关的免疫异常。随着对促成疾病形成因素的逐步深入了解,最终目标是开发针对自身免疫疾病的新型治疗方法,期待未来的研究可以进一步实现减轻自身免疫病患者的临床症状,甚至达到相关疾病的治愈。
作者简介:
迟欣欣,清华大学医学院免疫学研究所2015级直博生,导师是董晨教授。博士期间的主要研究方向为Th17细胞的发育及调控,主要关注Th17细胞命运决定过程的转录调控及其在炎症性疾病中的功能。目前于哈佛大学医学院从事博士后研究。
黄妙珍,2021年在荷兰格罗宁根大学医学院获得博士学位(受国家建设高水平大学公派研究生项目奖学金资助),2022年初加入清华大学医学院徐沪济教授团队从事博士后研究工作,获2022 年度清华-北大生命科学联合中心(CLS)博士后基金支持,目前主要方向为自身免疫疾病的免疫基因组学研究。
涂海林,清华大学医学院2016级直博生,师从医学院林欣教授。博士期间的研究方向为细胞程序性死亡在胚胎发育,炎症以及抗肿瘤免疫中的作用研究。2022年1月获得清华大学理学博士学位,目前在纽约大学医学院从事博士后研究,研究方向为肠道微生物与宿主免疫的相互作用。
张彬,清华大学医学院免疫学研究所2015级直博生,博士就读期间师从清华大学免疫学研究所胡小玉教授,主攻先天性免疫中巨噬细胞内炎性基因转录激活的分子机制,并结合临床疾病相关实验数据探究人单核细胞在炎性条件下的异质性以及相关免疫表型。现于加州大学旧金山分校糖尿病研究中心从事博士后研究。
原文链接:

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
