清华大学免疫所郭晓欢课题组发文揭示泌尿系统中3型天然淋巴样细胞介导的抗感染新机制
2022年1月12日,清华大学医学院免疫所郭晓欢课题组在《Advanced Science》杂志在线发表题为“Group 3 Innate Lymphoid Cells Protect the Host from the Uropathogenic Escherichia coli Infection in the Bladder”的研究论文,描绘了具有组织特异性的泌尿系统天然淋巴样细胞ILCs,并揭示了在尿道致病性大肠杆菌(Uropathogenic Escherichia coli, UPEC)引起的尿道感染早期,膀胱3型天然淋巴样细胞ILC3通过产生IL-17A介导膀胱组织清除UPEC的具体作用机制。

ILCs被称作获得性T淋巴细胞在天然免疫中的镜像细胞,包括NK细胞、ILC1、ILC2和ILC3,这些ILCs亚群不表达特异性抗原识别受体TCR、BCR,但却表达与对应的T细胞亚群相似的转录因子及效应分子,并发挥类似的免疫功能。近年来的研究显示,ILCs在黏膜系统中分布广泛,尤其在肠黏膜和呼吸道中含量丰富,且在调节共生菌群和抗感染中发挥重要作用。同时,多项研究也发现,ILCs能够受到组织信号的调控,在不同组织中展现异质性,表现出组织特异的表型和功能。然而,泌尿系统作为另一个重要的黏膜组成部分,目前关于ILCs在其中的分布、组成和功能的相关报道还很少。尿路感染是全球范围内发病率最高的细菌感染性疾病之一,且治疗手段单一、复发率高,给患者的正常工作和生活造成极大困扰,同时也形成了巨大的社会经济负担。因此,深入研究尿路感染相关免疫反应,以寻找更为有效的治疗靶点显得尤为迫切。于是,研究人员便围绕膀胱ILCs,对其分布、发育、表型及在尿道感染中的功能展开了全面分析。
首先,研究人员对小鼠膀胱和肾脏组织中的免疫细胞进行分离提取,根据经典ILCs亚群的定义方法,利用流式细胞术明确了ILCs各亚群在膀胱和肾脏组织中的分布情况。他们发现NK细胞是膀胱和肾脏中最主要的ILC亚群,而ILC1在泌尿系统中几乎检测不到;同时,膀胱和肾脏中都含有丰富的ILC2;ILC3主要存在于膀胱组织中,肾脏中比较少。
 膀胱中ILCs各亚群分布情况
膀胱中ILCs各亚群分布情况
接着,又结合转录因子、细胞表面分子以及趋化因子受体等的表达情况分析了膀胱中ILCs各亚群相较于小肠的组织特异性。结果显示,与小肠ILCs相比,膀胱中的I型ILCs表达更多的Eomes,表明膀胱较小肠具有更多的NK细胞;膀胱ILC2表达更高的ST2、更低的IL-25R,表明膀胱ILC2更能响应IL-33的刺激、而非IL-25;成年鼠肠道ILC3大部分是NKp46+ ILC3,而膀胱和肾脏中的ILC3绝大多数为CCR6+NKp46- LTi样细胞,同时与肠道ILC3相比,膀胱ILC3表达较低水平的MHC-II、PD-L1和RANK,提示膀胱ILC3可能在调控T细胞免疫方面与肠道ILC3不同;此外,膀胱ILC2和ILC3高表达整合素α4β7以及趋化因子受体CCR6,提示着膀胱ILC2和ILC3的归巢过程可能依赖于α4β7和CCR6。进一步,在发育方面,研究人员还明确了共有IL2Rγ链家族细胞因子受体和ID2在膀胱ILCs发育过程中的决定性作用;以及结合无菌鼠和抗生素处理小鼠发现了共生菌群不是膀胱和肾脏中ILCs各亚群的发育和维持的必需因素;并通过比较雌雄鼠发现性别对泌尿系统ILCs各亚群的分布也没有显著影响。
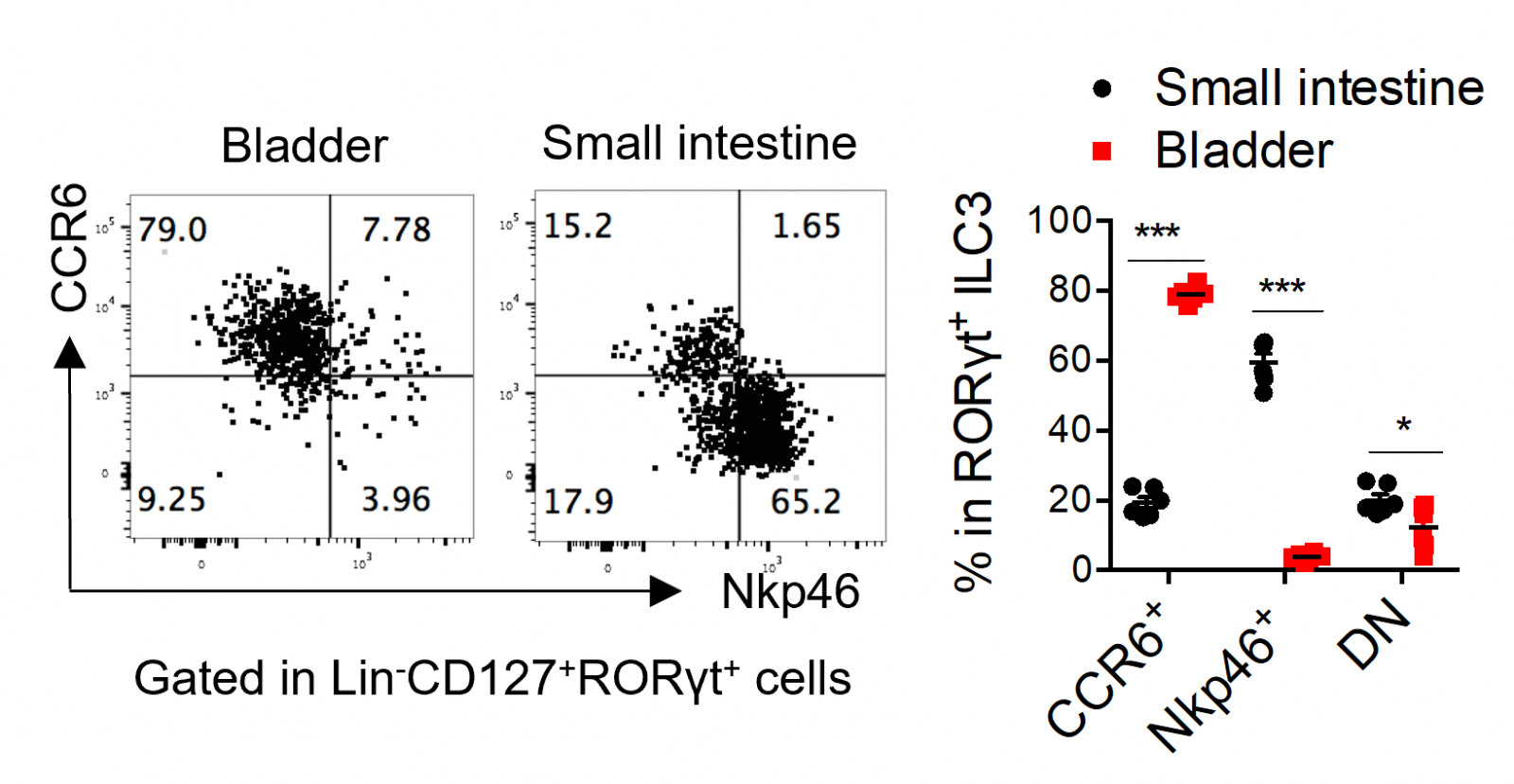 膀胱中的ILC3绝大多数为CCR6+NKp46- LTi样细胞
膀胱中的ILC3绝大多数为CCR6+NKp46- LTi样细胞
之后,为研究膀胱ILCs的功能,研究人员构建了UPEC诱导的小鼠急性尿路感染模型,感染之后他们发现膀胱ILCs对感染产生了明显的应答反应,尤其是ILC3产生的IL-17A和IL-22在感染后明显被诱导。而后,他们结合ILCs全缺陷小鼠及ILC2或ILC3单一缺陷小鼠证实了膀胱ILC3而非ILC2在UPEC引发的尿道感染早期对于促进UPEC清除起到了决定性作用。
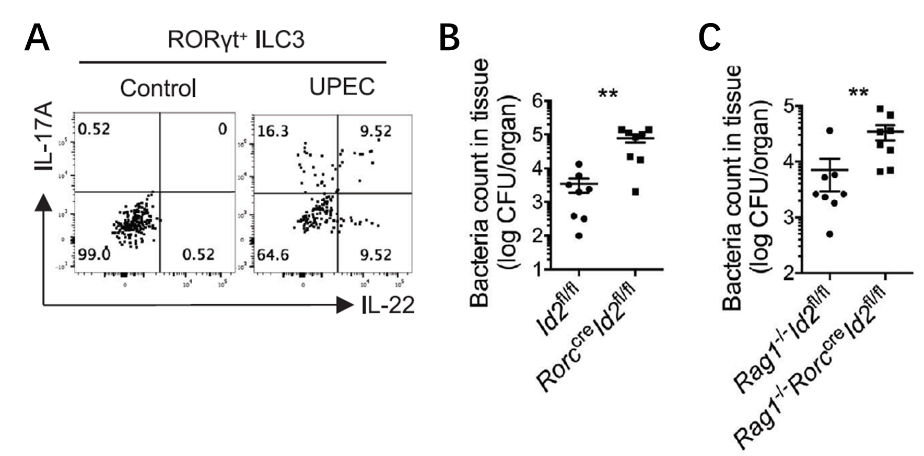
ILC3的快速免疫应答在机体早期控制小鼠尿路急性感染过程中发挥重要作用
最后,研究人员又进一步探究了膀胱ILC3发挥功能的具体作用机制。转录水平及蛋白水平的结果均显示,在UPEC感染早期,膀胱组织会迅速产生大量前炎症因子IL-1β,而结合体外刺激实验及体内抗体中和等实验证实,IL-1β与Myd88通路是诱导膀胱ILC3产生效应因子IL-17A和IL-22的主要上游激活信号。
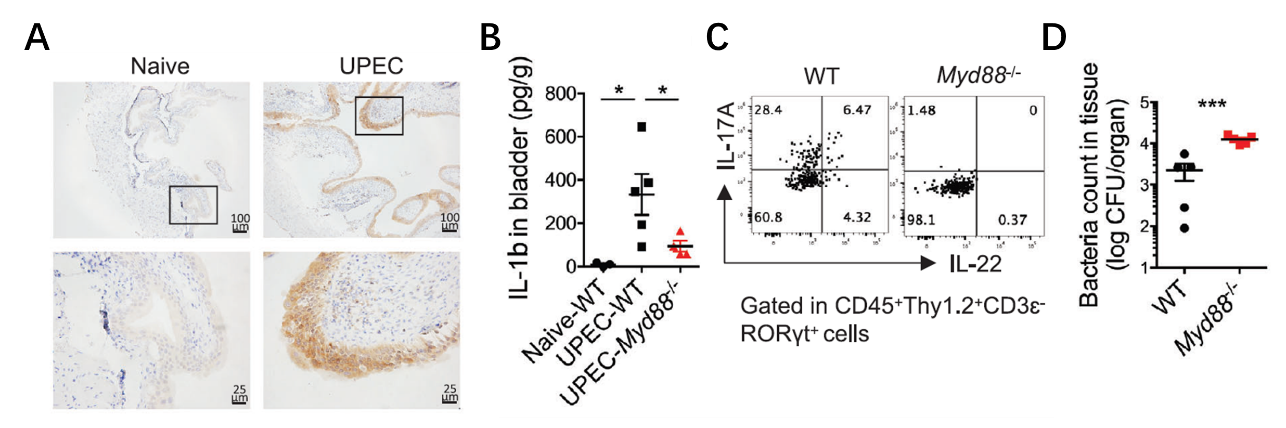 IL-1β与Myd88通路介导了UPEC感染后膀胱ILC3的活化
IL-1β与Myd88通路介导了UPEC感染后膀胱ILC3的活化
此外,研究人员也探讨了ILC3产生的效应因子是如何介导UPEC的早期清除。他们发现,膀胱ILC3的缺失会导致感染早期炎性趋化因子产生减少以及中性粒细胞的浸润减少。而该过程主要通过IL-17A介导,一方面膀胱组织高表达IL-17A受体,提示着其能够对IL-17A信号产生较强的应答能力,另一方面ILC3的缺陷造成感染早期膀胱产生IL-17A的能力大大降低,而在给ILC3缺陷型小鼠回补IL-17A后,能够提高膀胱组织产生炎性趋化因子的能力,促进中性粒细胞的早期浸润,进而促进UPEC的清除。然而,研究人员还发现,膀胱组织中IL-22受体的表达水平较低,且IL-22的回补以及抗IL-22中和性抗体的处理均不能改变小鼠清除UPEC的能力,因此可以说明,IL-22在尿路感染早期对于UPEC的清除并没有产生显著影响,而它是否具有其它功能还需进一步探究。
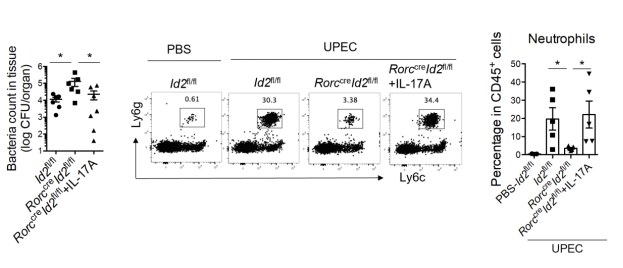
ILC3通过分泌IL-17A招募中性粒细胞控制UPEC尿路感染
综上所述,该研究比较全面地刻画了了泌尿系统ILCs的表型及功能,重点揭示了在UPEC引起的急性尿道感染中,膀胱组织细胞产生IL-1β,刺激固有层中的ILC3快速产生IL-17A,IL-17A诱导膀胱组织分泌趋化因子招募中性粒细胞,进而通过中性粒细胞实现对UPEC的清除作用。该研究既是对泌尿系统黏膜免疫及ILCs相关科学知识的补充与完善,又为临床防治尿路感染提供了理论基础和潜在药物靶点。
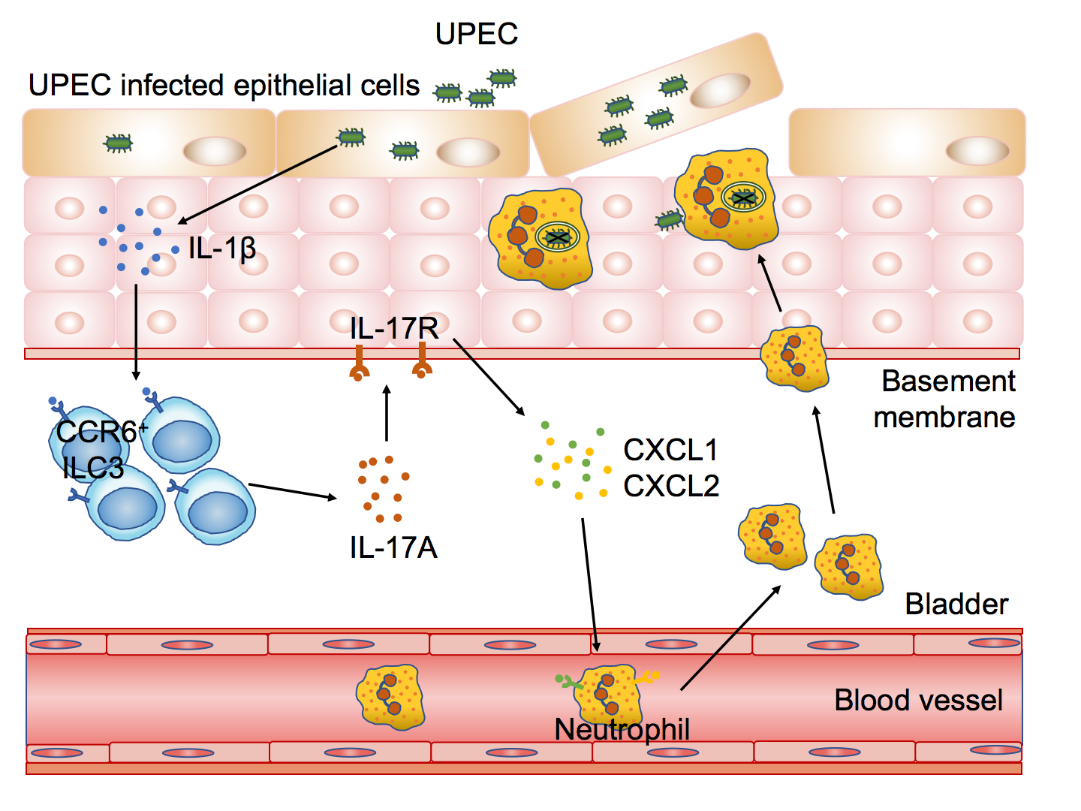
膀胱ILC3介导抗UPEC感染的机制模式图
清华大学医学院免疫学研究所郭晓欢研究员为该文的通讯作者,已毕业的黄娇艳博士为该文的第一作者。此外,付榴辉博士、博士生黄济达、博士生赵杰、博士生张鑫、博士后王文彦、博士生刘叶阳以及孙博文博士为该研究做出了重要贡献。该研究还得到了中国科学院上海营养与健康研究所邱菊教授以及清华大学医学院免疫所胡小玉教授和刘志华教授的大力支持。该研究还得到了清华大学免疫学研究所和清华大学生物医学测试中心实验动物中心的大力支持。该研究受到了国家自然基金委、国家重点研发计划、清华-北大生命联合中心等项目资助。
原文链接:http://doi.org/10.1002/advs.202103303

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
