2018年6月21日,清华大学免疫研究所董晨课题组在国际知名期刊《Journal of Experimental Medicine》在线发表题为“Trim33 mediates the pro-inflammatory function of Th17 cells”的研究论文。该论文揭示了TGF-β通过Trim33调控Th17细胞的分化发育和促炎功能,并阐明了其作用机制,从而为Th17细胞相关的免疫疾病治疗提供了新思路。
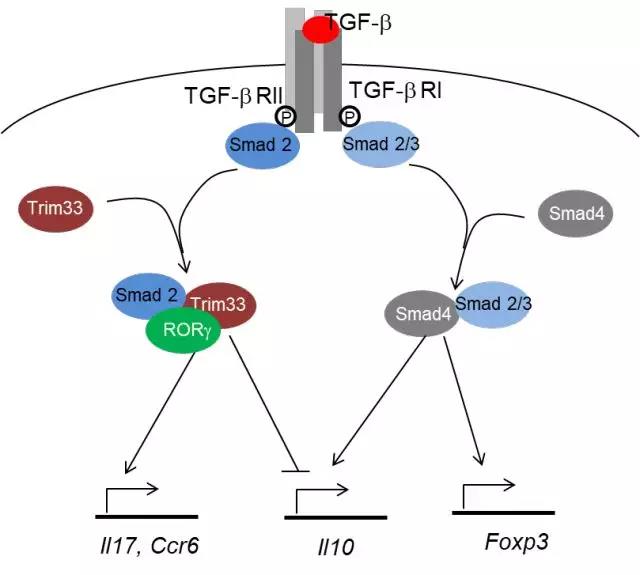
TGF-β分别通过Trim33和Smad4调控T细胞的促炎和抗炎功能
Th17细胞是一种与多种自身性免疫疾病的发生密切相关的促炎性细胞。董晨课题组自2005年发现并鉴定Th17细胞之后,在该领域持续发表了一系列工作。TGF-β和IL-6共同诱导了Th17细胞的发育, 但是TGF-β却调控抗炎的表达Foxp3的调节性T (Treg) 细胞的分化。经典的TGF-β通路由Smad家族蛋白介导,然而在Th17细胞发育中TGF-β的调控机理则并不是很清楚。董晨实验室过去和冯新华实验室合作, 发现Smad2/3/4共同介导Foxp3的表达, 而只有Smad2 调控Th17分化。Trim33是转录因子中介子家族(Transcription intermediary factor 1)的一员,近年的研究发现它参与调控TGF-β信号通路,但对它在免疫系统中的功能则尚缺乏了解。此外,Th17细胞根据功能的不同被分为致病性和非致病性Th17细胞两种状态,而IL-10的分泌与否是二者的重要区分标志。
董晨课题组发现 Trim33缺失的T细胞向Th17 细胞分化的能力受损,促炎的IL-17表达降低,而抗炎的IL-10分泌升高,说明Trim33调控了Th17细胞的促炎功能。在体内,Trim33fl/flCD4cre小鼠的自身性免疫疾病EAE减轻,中枢系统浸润的Th17细胞减少。尽管Th17和iTreg细胞的分化发育都需要TGF-β的诱导,然而Trim33的敲除却不影响iTreg细胞的分化。与之相对的是,TGF-β通路的co-Smad蛋白Smad4则调控iTreg的分化,不影响Th17细胞的分化和IL-17的分泌。此外,Smad4缺失的Th17细胞IL-10下降,说明在T细胞分化过程中,TGF-β分别通过Trim33和Smad4发挥着促炎和抗炎两种相反的作用。
通过进一步在基因组水平上的研究,董晨课题组还发现Trim33能够直接结合Il17、Il10的调控区域,影响其位点的组蛋白修饰,并且它在靶基因上的结合依赖于Smad2。Trim33还能作为泛素化的E3连接酶,降解Smad4蛋白,进一步抑制Il10的表达,促进Th17细胞的致病性功能。另一方面,Trim33能分别和Smad2、RORγt结合形成复合物,共同调控下游基因的表达。因此,Trim33通过不同的机制多方位调控了Il17、Il10的表达和Th17的促炎功能。
董晨教授为该研究的通讯作者,董晨课题组前博士后、 现就任日本九州大学助理教授的Shinya Takara是该文的第一作者,清华大学研究生江雨是第二作者, 其他合作者包括来自美国MD Anderson癌症中心、西雅图系统生物学研究所等的研究人员。该研究进行过程中曾受到国家自然科学基金、科技部项目、北京市重点实验室和美国国家卫生研究院的共同资助。
原文链接:http://jem.rupress.org/content/early/2018/06/20/jem.20170779

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
