【突破】肠道菌群也能操控皮肤炎症?清华大学林欣团队揭示:肠道菌群经“代谢接力”操控皮肤 Th17 炎症反应
撰文 |王晨良、戴尚志等
近年来,肠道菌群作为人体最大的共生微生物群落,被广泛认为是调控宿主免疫稳态和多种疾病的重要因素。大量研究已揭示肠道菌群通过代谢产物、免疫细胞活化以及神经内分泌途径影响远端组织,包括肝脏、肺脏甚至中枢神经系统。然而,肠道菌群能否以及如何调控皮肤免疫反应,长期以来缺乏直接证据。
银屑病(Psoriasis)是一种常见的慢性炎症性皮肤病,全球患病率约 3%。其发病机制涉及遗传与环境因素的复杂互作。尽管全基因组关联研究(GWAS)已鉴定出数十个易感基因,但仅能解释约 30%的遗传风险,提示环境因素在疾病发生中发挥关键作用1。近年来,肠道菌群紊乱作为重要的环境扰动因子被认为与银屑病相关,但具体机制尚不清楚。早期临床观察与实验研究提示,抗生素治疗可缓解部分银屑病患者的症状,当时这一现象多被解释为抗生素抑制了链球菌或葡萄球菌等潜在致病菌感染,尤其是在伴随扁桃体链球菌感染诱发或加重的点滴状银屑病中。然而,这一传统观点忽视了抗生素对肠道共生菌群组成与代谢活动的广泛影响。因此,抗生素相关疗效究竟源自抑制感染还是重塑肠道共生菌群,长期存在认识上的偏差。
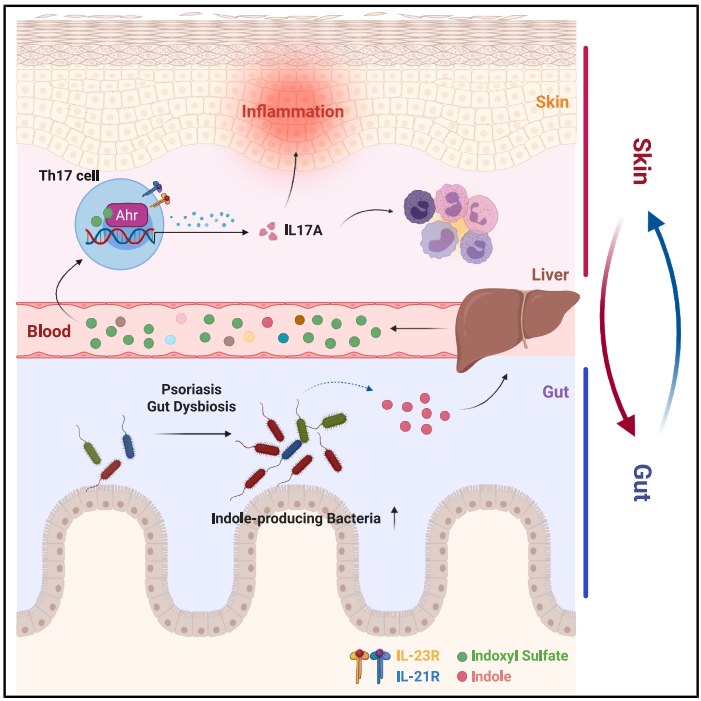
2025年 9月 9日,清华大学免疫学研究所林欣教授团队在 Immunity在线发表题为 “Gut microbe-derived metabolites drive psoriatic inflammation via modulation of skin Th17 cells”的研究论文。该研究基于本团队先前报道的Card14E138A/+自发银屑病小鼠模型2,结合单细胞测序、代谢组学、微生物组学及多组学整合分析,首次揭示了肠道共生菌群通过代谢色氨酸产生吲哚,并经宿主代谢接力的模式生成硫酸吲哚酚(Indoxyl Sulfate, I3S),进而激活芳香烃受体(Aryl Hydrocarbon Receptor, AHR)来重塑皮肤 Th17细胞的表观遗传状态并增强其效应功能,最终远程驱动银屑病炎症。
研究显示,银屑病小鼠不仅存在显著的 Th17细胞扩增,其血清中吲哚类代谢物亦明显富集。通过不同抗生素处理策略发现,只有清除肠道菌群而非皮肤菌群才能缓解疾病表型,提示肠道菌群在驱动炎症中占主导地位。结合单细胞、Bulk-RNA测序技术和粪菌移植实验进一步证实,银屑病小鼠肠道菌群可通过 Th17细胞加重疾病发生。利用方向性交叉筛选方法,研究者将关键代谢物锁定为 I3S。I3S在银屑病小鼠血清和皮肤中显著升高,而在抗生素清除肠道菌群后明显下降。体外实验表明,I3S能以剂量依赖方式促进 Th17分化;体内补充 I3S可加重病程。机制研究显示,I3S作为 AHR配体,可增强Il17a/f、Il23r等位点的染色质开放性,强化 Th17功能。T细胞特异性 AHR缺失可有效缓解炎症,验证了 I3S–AHR通路的关键作用。
值得注意的是,作为吲哚的硫酸化产物,I3S的生成高度依赖于肠道菌群提供的吲哚3。定量检测发现,吲哚仅在结肠组织中富集,而在皮肤等外周组织中未见信号。进一步实验表明,定植缺失 TnaA的大肠杆菌(吲哚合成缺陷株)可降低宿主 I3S水平并缓解炎症,揭示了“菌群—宿主代谢接力”的实质。临床样本显示,患者血清 I3S水平与疾病严重程度正相关,提示其作为生物标志物和潜在治疗靶点的价值。该项研究中所用临床研究队列建立及样本收集由北京大学第一医院皮肤科合作提供。
本研究系统阐明了肠道菌群通过吲哚代谢驱动 I3S合成,并经 AHR信号调控 Th17细胞功能,从而放大皮肤炎症的分子机制。这不仅为“肠-皮轴”提供了新的证据,也为银屑病治疗开辟了新方向:针对产吲哚菌群、I3S合成途径或 AHR信号的干预策略均可能具有临床潜力。
清华大学基础医学院、清华大学免疫学研究所林欣教授担任该论文的通讯作者。免疫所已毕业博士生王晨良、已出站博士后戴尚志(现为北京大学第一医院皮肤科医生)和已毕业博士生张珊珊共同担任第一作者。清华大学基础医学院郑哲宇、周志霄博士为课题提供了重要帮助。此项研究得到了多个实验室和平台的重要支持:清华大学董晨实验室提供了本研究的部分小鼠品系,清华大学刘锦涛实验室在大肠杆菌基因敲除方面提供了宝贵的帮助。该研究获得了科技部重点研发计划,国家自然科学基金重大项目等项目的资助支持。
原文链接:
https://www.cell.com/immunity/abstract/S1074-7613(25)00369-3
参考文献
1.Griffiths, C.E.M., Armstrong, A.W., Gudjonsson, J.E., and Barker, J.N.W.N. (2021). Psoriasis. The Lancet 397, 1301–1315. https://doi.org/10.1016/S0140-6736(20)32549-6.
2.Wang, M., Zhang, S., Zheng, G., Huang, J., Songyang, Z., Zhao, X., and Lin, X. (2018). Gain-of-Function Mutation of Card14 Leads to Spontaneous Psoriasis-like Skin Inflammation through Enhanced Keratinocyte Response to IL-17A. Immunity 49, 66-79.e5. https://doi.org/10.1016/j.immuni.2018.05.012.
3.Graboski, A.L., Kowalewski, M.E., Simpson, J.B., Cao, X., Ha, M., Zhang, J., Walton, W.G., Flaherty, D.P., and Redinbo, M.R. (2023). Mechanism-based inhibition of gut microbial tryptophanases reduces serum indoxyl sulfate. Cell Chemical Biology 30, 1402-1413.e7. https://doi.org/10.1016/j.chembiol.2023.07.015.

Copyright © 2017 Institute for Immunology Tsinghua University
Contact Address: Room D302, Medical Science Building, Tsinghua University, Beijing 100084, China
Tel: (86) 10-62776420 Fax: (86) 10-62776420
