2021年12月7日,清华大学免疫所彭敏课题组在《Cell Reports》发表题为“Genome-wide fitness gene identification reveals Roquin as a potent suppressor of CD8 T cell expansion and anti-tumor immunity”的研究论文。该研究使用体外、体内CRISPR筛选,系统性鉴定了全基因组水平调控CD8 T细胞扩增的基因,并揭示了Roquin-IRF4轴在T细胞扩增和肿瘤免疫治疗中的重要作用。
T淋巴细胞在抗感染和抗肿瘤等方面发挥关键作用。识别特定抗原表位的初始T细胞数量极少,激活后需要经历大量的克隆性增殖,达到足够的数量后才能有效清除靶细胞。然而,基因组中有多少基因参与调控T细胞扩增尚不清楚。深度剖析T细胞扩增的调控机制,不仅可以加深我们对这一复杂生命现象的理解,也有助于发现免疫治疗的新靶点。
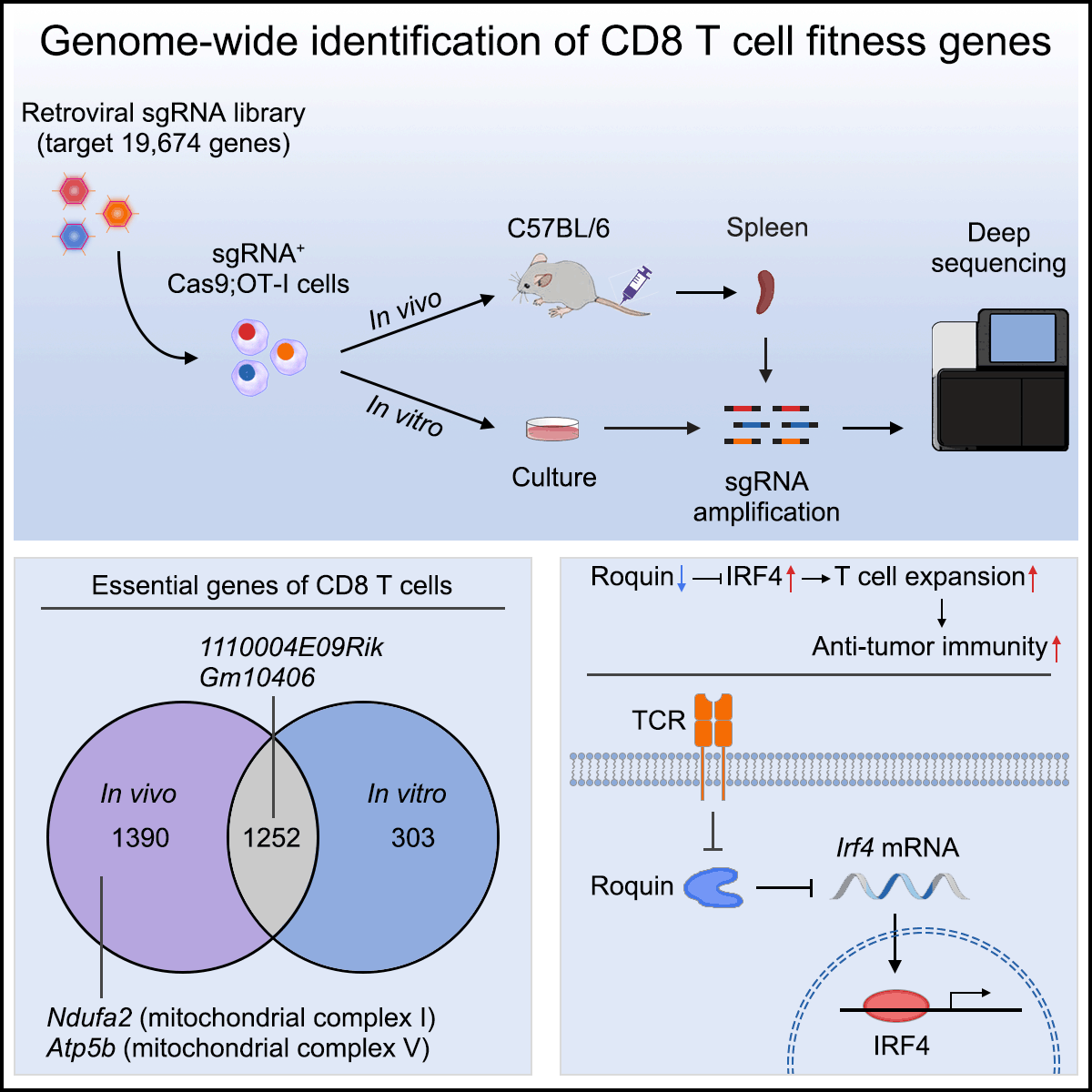
作为一种高效的基因功能分析平台,基于CRISPR/Cas9基因编辑的高通量遗传筛选在近几年里发展迅速。但是,使用原代细胞进行全基因组水平筛选仍具有很大挑战性。为了系统性地鉴定T细胞扩增的调控基因,彭敏课题组建立了T细胞全基因组CRISPR小鼠体内筛选系统,并平行比较了体内和体外筛选的敏感性和效能差异。作者发现了许多新的参与调控T细胞扩增的必需基因,包括生物学功能未知基因1110004E09Rik和Gm10406。通过比较体内和体外筛选结果,作者还揭示了CD8 T细胞在体内环境中扩增的特定必需基因,其中许多基因富集在能量代谢调控途径。接下来,作者进一步将注意力聚焦到抑制CD8 T细胞扩增的基因,筛选结果显示Rc3h1显著抑制CD8 T细胞增殖。Rc3h1编码调节炎症的RNA结合蛋白Roquin,但是Roquin在CD8 T细胞中的功能仍不清楚。经验证,敲除Roquin会大幅度促进过继性转移CD8 T细胞的增殖能力,并有效地增强了对荷瘤小鼠的治疗效果。在机制方面,通过转录组分析发现Irf4是Roquin下游的一个关键功能性靶mRNA。在Roquin缺失的CD8 T细胞中,Irf4转录和翻译水平的表达量均有所增加,同时敲除IRF4能够将Roquin缺失引起的增殖促进作用恢复至野生型T细胞水平。而且,过表达IRF4也能够促进过继性转移CD8 T细胞的增殖能力,并增强抗肿瘤效果。
综上,彭敏课题组在原代CD8 T细胞中建立了全基因组水平的体外、体内CRISPR筛选体系,为领域提供了调控T细胞扩增的基因参考目录,包括先前未知的扩增必需基因。而且,作者证明了CD8 T细胞的增殖抑制因子Roquin及其下游IRF4作为癌症治疗靶点的可能性,为肿瘤免疫治疗领域供了新的策略及理论基础。
清华大学免疫所彭敏研究员为本文通讯作者,清华大学免疫所博士生赵翰飞为本文第一作者,博士生刘莹、博士后王丽霞对本研究也做出了重要贡献。本研究获得了国家自然科学基金委、清华-北大生命科学中心以及清华大学免疫学研究所的支持。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01574-6
此外,本文主要作者受邀Cell Press细胞出版社的“Cell Press对话科学家”栏目接受采访。

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
