2019年9月13日,清华大学免疫学研究所林欣课题组在《Nature Communications》期刊上在线发表了题为” K63-linked ubiquitination regulates RIPK1 kinase activity to prevent cell death during embryogenesis and inflammation”的文章,揭示了RIPK1的K63泛素化修饰可通过调节RIPK1的激酶活性来抑制胚胎发育和炎症发生过程中的细胞死亡,为研究程序性死亡调节生理过程提供了新的视角。
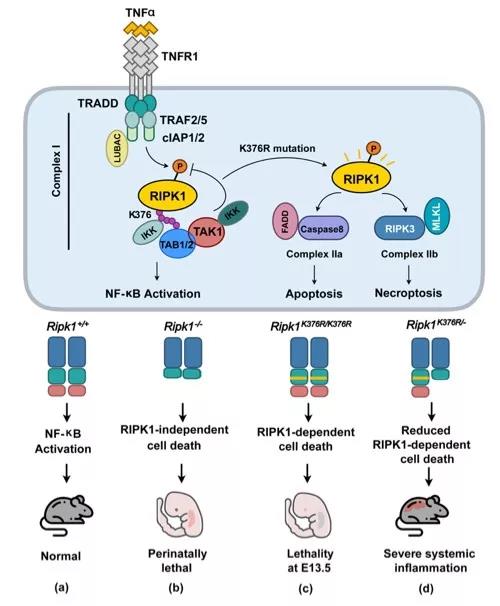
RIPK1(Receptor interacting kinase 1)是一个丝氨酸和苏氨酸激酶,可以参与调节细胞存活和细胞死亡过程。RIPK1的功能在TNFα介导的信号通路中被广泛研究,它的激酶活性对其参与的调控过程至关重要。此前的研究表明,蛋白质翻译后修饰,包括泛素化和磷酸化参与了RIPK1的激酶活性调控过程。但是这些修饰如何调控RIPK1的激酶活性以及如何通过这些修饰来影响程序性死亡过程的机制尚未研究清楚。10多年前,当时还在美国安德森癌症中心的林欣课题组和美国德州大学西南医学中心的James Chen课题组曾应用生化实验分别独立发现了RIPK1的K63泛素修饰可参与TNFa诱导的NF-kB信号,并鉴定了人源RIPK1的泛素化修饰位点是Lys377(K377)。但是鉴于技术手段和背景知识的限制,当时对于RIPK1的K63泛素化修饰是否参与调节其激酶活性以及这个修饰的生理作用不很清楚,而且迄今没有被研究。
在本研究中,研究者通过氨基酸保守性分析寻找到了Lys376(K376)是鼠源RIPK1的K63泛素化位点,并利用Crispr-Cas9技术构建了K376R突变小鼠。研究发现,RIPK1 的K376R突变会造成小鼠在胚胎期E13.5致死,在胚胎里可检测到大量的细胞死亡和严重的肝损伤。Ripk1K376R/K376R小鼠致死期远早于Ripk1-/-小鼠,暗示了RIPK1的K63泛素化修饰对RIPK1参与调节细胞生死的重要性。进一步研究发现,Ripk1K376R/K376R突变会加速TNFa诱导的细胞凋亡和坏死过程。虽然K376R突变会降低NF-kB的激活,但NF-kB激活水平的降低并不是RIPK1K376R/K376R细胞死亡增多的主要原因。他们注意到RIPK1的激酶活性在K376R突变的细胞中显著增加,通过一系列生化细胞实验,他们最终揭示了调控机制,即RIPK1在K376上的K63泛素化修饰可招募TAK1-IKK复合物来抑制RIPK1的激酶活性,当发生K376R突变时会造成RIPK1的激酶活性不被抑制,进而促进了细胞死亡的发生。
那么是否是细胞死亡造成了Ripk1K376R/K376R小鼠的胚胎致死呢?他们发现,TNFR1的缺失可延缓Ripk1K376R/K376R小鼠的胚胎致死,在出生12天后由于严重的炎症反应而致死。而RIPK3和caspase8同时缺失可完全抑制Ripk1K376R/K376R小鼠的死亡和炎症过程。更有趣的是,研究者获得了Ripk1K376R/-小鼠,该小鼠会在出生后由于严重的炎症反应而致死。与Ripk1K376R/K376R相比,Ripk1K376R/-细胞只有单拷贝的RIPK1存在,因此它的激酶活性相对减弱,这解释了Ripk1K376R/-小鼠的表型。相似的,Ripk1K376R/-小鼠炎症表型也会由于TNFR1缺失或者RIPK3/Caspase8的缺失而被抑制。他们的这些发现,在生理条件下,揭示了RIPK1的K63泛素化修饰对调节胚胎发育和炎症反应过程的重要性,对于深入了解RIPK1在相关疾病中的功能和机制有重要作用。
清华大学医学院林欣教授为本文的通讯作者,清华大学医学院2013级博士生唐勇和2016级博士生涂海林为该论文的共同第一作者,论文的其它作者包括2016级博士生张杰、医学院副研究员赵学强老师,以及国家蛋白质科学中心(凤凰中心,北京)秦钧教授和博士后王旖旎。该课题得到国家自然科学基金委和清华-北大生命科学联合中心的资助。
值得一提的是,同一天《Nature Communications》 同时在线发表了中科院上海生命科学研究院章海兵课题组相同结论的研究论文。
原文链接:
https://www.nature.com/articles/s41467-019-12033-8

版权所有©2017 清华大学免疫学研究所
地址:清华大学医学楼D302,北京,100084
电话:010-62776420 传真:010-62776420
